L-乳酸化是一种新发现的发生在组蛋白赖氨酸残基上以调节基因表达的翻译后修饰,而在非组蛋白中的乳酸化底物范围仍然未知。
北京大学深圳研究院在《Chemical Science 》期刊发布题为"A bioorthogonal chemical reporter for the detection and identification of protein lactylation"的文章,报道了一种可用于鉴定和检测哺乳动物细胞中蛋白乳酸化的探针。
研究背景
有研究表明乳酸通过介导乳酸化修饰,调控基因表达来发挥肿瘤代谢、免疫等生物功能。乳酸化作为一种新发现的PTM,其生物学作用和调控元件尚未发现,乳酸化底物蛋白的鉴定是剖析乳酸化的生物学功能的必要步骤,组蛋白的乳酸化研究已有一定的成熟度,但而前非组蛋白中乳酸化底物的检测与鉴定仍然存在很大的难度,因而,需要一种可全面检测和鉴定蛋白乳酸化的可靠技术,在本研究中,作者报道了一种炔基功能化的生物正交化学报告物YnLac(探针)用于检测和鉴定哺乳动物细胞中的蛋白乳酸化。
生物正交化学是一种生物标记-报告方法,其主要方式是利用活体生命系统的生物合成系统将特定的化学分子小基团整合到目的生物分子上。近来,生物正交化学报告技术在多种蛋白PTM研究占越来越重要的作用,如糖基化、酯化等,其技术原理为PTM 供体前体的炔基或叠氮基衍生物(化学报告分子)通过代谢结合到活细胞中携带 PTM 的蛋白质中,并允许用生物正交基团标记感兴趣的蛋白质,标记的蛋白质随后通过生物正交反应与荧光团或亲和标签结合,用于荧光检测或蛋白质组学鉴定。
技术手段
实验材料:HEK293T细胞、探针YnLac、
研究方法:乳酸化修饰鉴定、WB、IP
研究内容
乳酰化化学报告基因的设计及表征验证
在之前和相关研究中发现,外源性l-乳酸钠添加到细胞培养基中,以提高组蛋白乳酸化水平,同位素 l-乳酸钠被代谢掺入乳酰化组蛋白中。此外,附加有荧光标签的 l-乳酸类似物已被用作 l-乳酸模拟物以研究其在活细胞中的转运和代谢。受这些研究的启发,作者设想L-乳酸的炔基类似物可以被代谢并掺入活哺乳动物细胞中的乳酰化蛋白中。因此设计并合成了一种l-乳酸钠衍生物,即(S)-2-羟基戊-4-戊酸钠(YnLac),它含有原始甲基上的末端炔基,作为检测和分析蛋白质乳酰化的潜在化学报告基因。为了研究YnLac是否可以代谢掺入活哺乳动物细胞的蛋白质中。作者将HEK293T细胞与YnLac一起孵育,通过胶内荧光以及细胞荧光成像初步验证了探针YnLac可以在活细胞中实现代谢标记,实验数据还表明,该探针与天然的乳酸有类似的生物功能,能够经由乳酸的修饰途径对存在乳酸化修饰的蛋白进行代谢标记等。
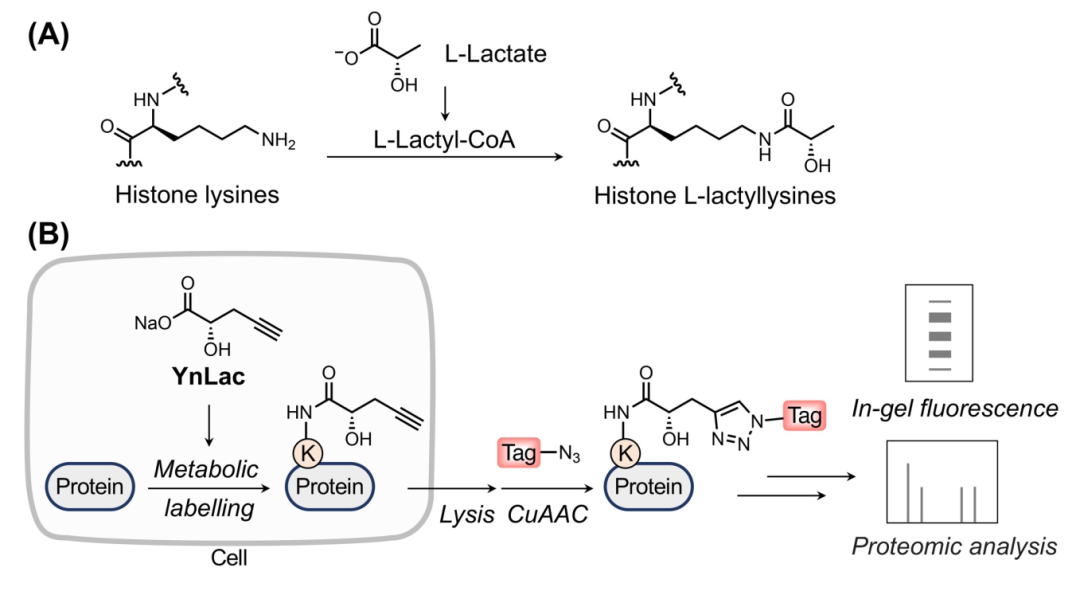
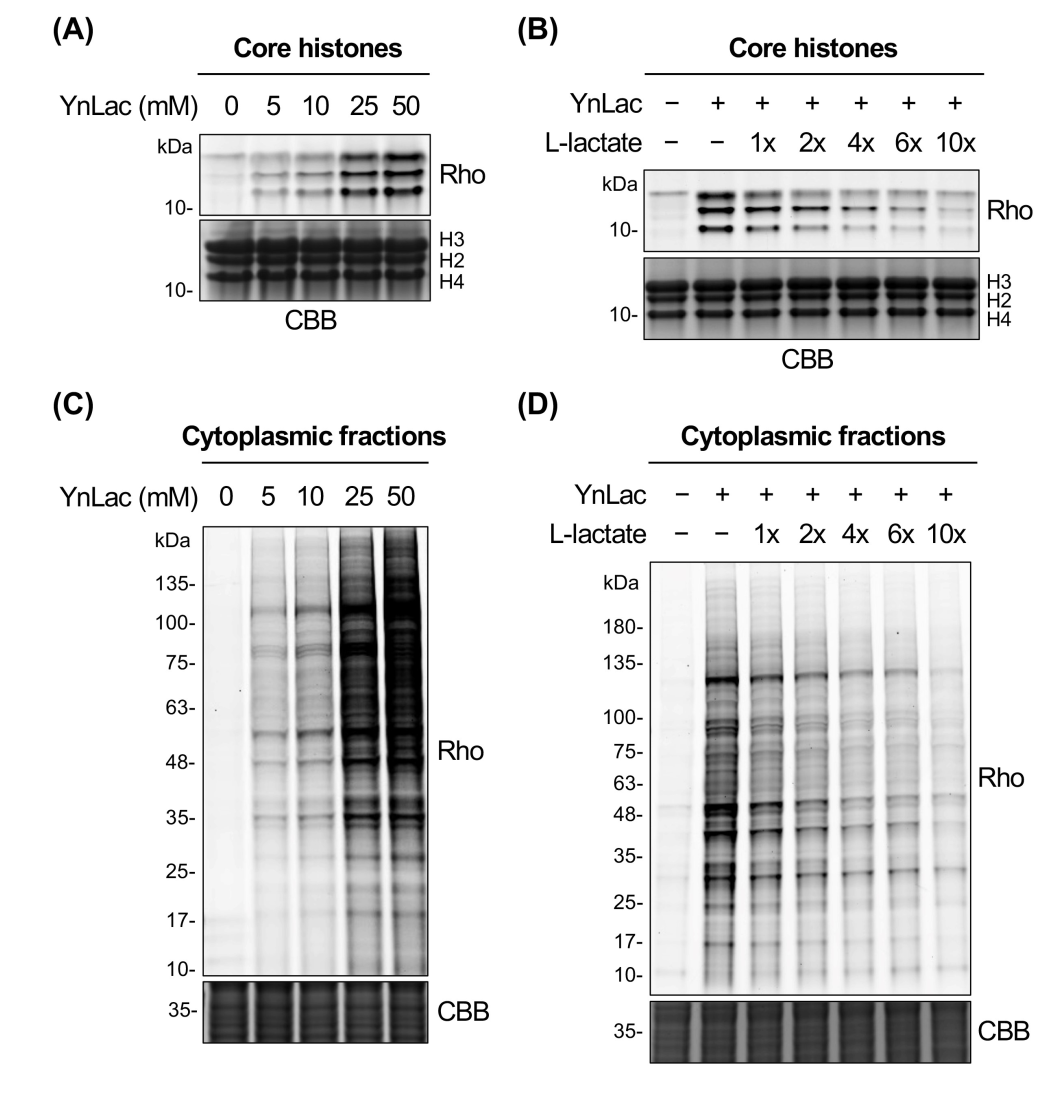
使用 YnLac 对乳酰化进行化学蛋白质组学分析
通过MS分析验证YnLac修饰蛋白质的赖氨酸残基,在核组分中鉴定了 19 个 YnLac 修饰位点,包括组蛋白中的 13 个已知位点和 2 个未报道的乳酰化位点以及非组蛋白中的 4 个新位点。分析数据表明,YnLac直接靶向蛋白质上的赖氨酸残基,可用于在蛋白质组范围内鉴定新的乳酰化位点。运用YnLac对非组蛋白中的其他乳酰化位点鉴定,结果鉴定出细胞质组分的 51 种非组蛋白中的 96 个赖氨酸残基含有 YnLac 修饰,有个组蛋白与非组蛋白的含有共同的修饰位点,总的来说,作者共在 62 种蛋白质中鉴定了 114个乳酰化位点。对这些位点进行生物信息学分析,结果表明,乳酰化主要发生在与各种核生物过程相关的蛋白质上,例如 RNA 加工/代谢、染色体组织和 DNA 修复。
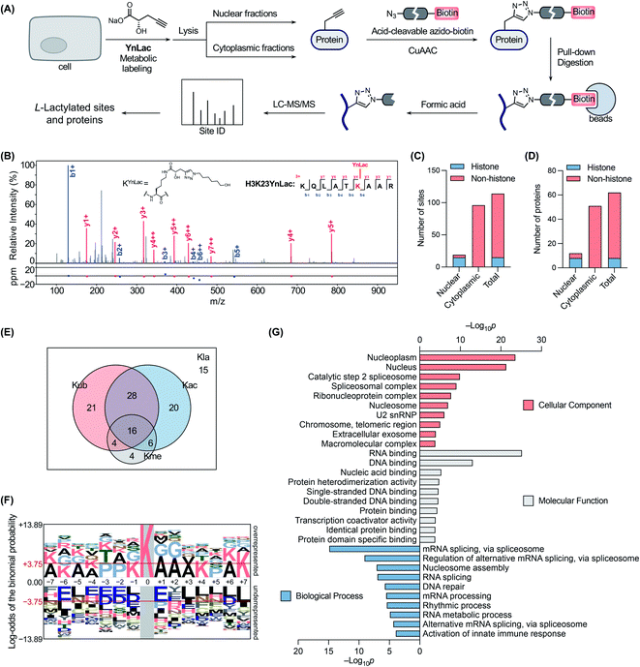
新的乳酰化底物蛋白的验证
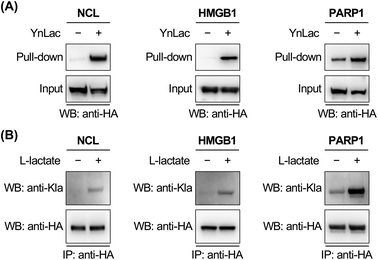
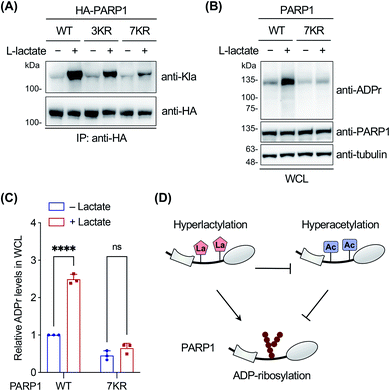
作者还利用WB、IP验证了几种代表性非组蛋白的乳酸化鉴定,结果表明,这些候选乳酰化蛋白确实被 YnLac 特异性标记和富集且被真实乳酸化,在PARP1的乳酸化功能研究实验中发现L-乳酸诱导 PARP1 乳酰化,且乳酰化的 PARP1 表现出ADP-核糖基化活性的增加,此外还发现乳酰化在DNA修复过程中具有潜在的调节作用等。