双免疫检查点阻断药治疗(DBT)相比于单药治疗有更强的抗肿瘤效果,但目前仍缺乏有效的生物标志物来监测DBT的治疗反应。

研究背景
过去十年中,虽PD-1和CTLA4等免疫检查点抑制剂(ICI)药物在肿瘤治疗中有令人惊喜的效果,但ICI单药治疗只对一部分晚期肿瘤患者有效,还有大多数患者需要另寻其他的药物治疗。此外,许多接受ICI治疗的患者会出现一些免疫相关不良反应(irAE),如在非小细胞肺癌甲状腺患者治疗后ICI会导致甲状腺功能障碍,此外在结肠炎、腹泻、皮肤病毒性、内分泌病、肝毒性和肺炎等ICI治疗中也表现出irAE,限制了ICIs免疫疗法的临床应用。因而DBT成为解决上述问题的重要改进策略。研究表明,DBT(如抗PD1和抗CTLA4 ICIs的联合治疗)可显着提高黑色素瘤(从43.7%到57.6%)和非小细胞肺癌(NSCLC)(35.9%)的客观缓解率(ORR),显然,DBT是免疫疗法的下一个合乎逻辑的策略,可提高反应率,提高治愈率和反应持续时间。但目前DBT的相关生物标志物尚未开发出来。
血浆是临床实践中用于诊断分析的主要样品,基于质谱的蛋白组学能为生物医学和临床研究提供深入的蛋白质鉴定和稳定定量,使其适用于疾病机制、药物疗效和生物标志物探索的研究。
技术手段
实验材料:22名患有不同癌患者接受抗PD1和抗CTLA4DBT治疗的29个治疗周期的共113份血浆样本,27名接受抗PD1单药治疗患者的54份血浆样本, 24名健康对照者的24份血浆样本。
研究内容
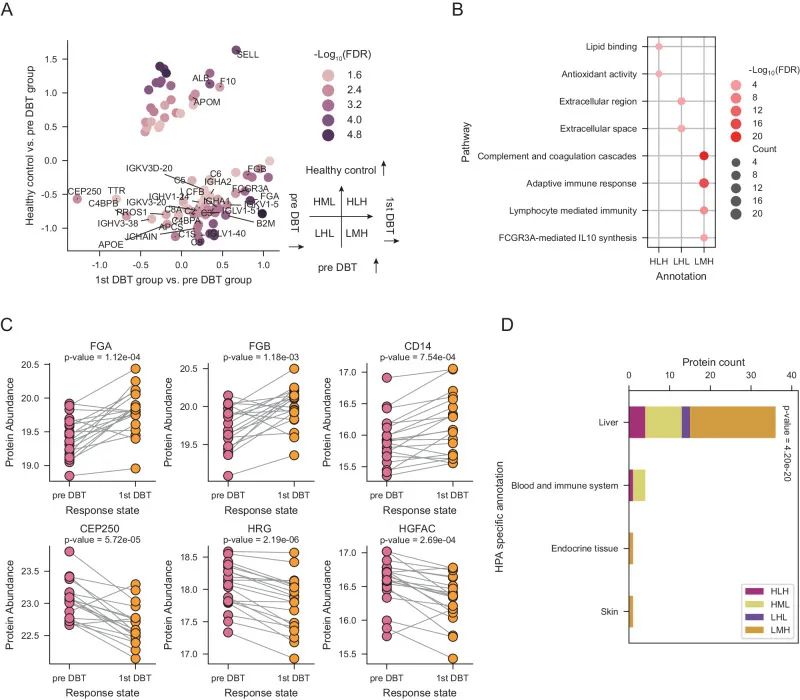
血浆蛋白组显示患者接受DBT后胆固醇的代谢与致癌信号传导负相关
通过对实验设置组的差异蛋白(DEP)进行过表达分析以探索其富集的生物学过程,结果表明,DBT对胆固醇过程、免疫反应和致癌信号传导有强烈影响。为了知道DBT是否主要影响特定的器官,作者将DEP与HPA数据库进行了比较,结果发现大部分DEP被注释为肝脏特异性蛋白,此外评估了DBT治疗前与治疗第一个周期的样本肝功能指标,发现多种与肝功能损害相关的酶水平均升高,这反映DBT的临床治疗试验应考虑肝功能损害和可进一步研究DBT与肝功能之间的联系等。
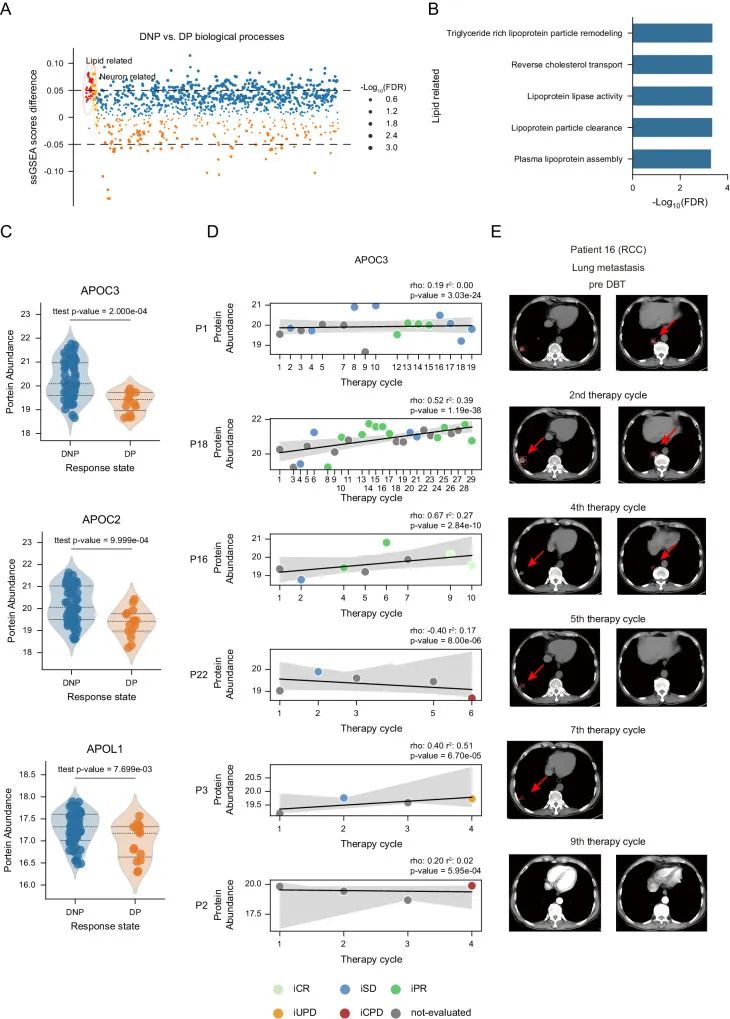
蛋白质组和放射成像的综合分析揭示了 APOC3 作为 DBT 生物标志物的潜力
为了进一步说明DBT临床指标和蛋白质组特征的改变,作者将实验样本中的iUPD和iCPD样本分为疾病进展组(DP),iPR和iSD作为疾病非进展组(DNP),作者分别比较DP组和DNP组的临床指标和研究其血浆蛋白组数据的差异,结果发现,DNP组的高密度载脂蛋白成分APOC3、APOC2和APOL1水平高于DP组,暗示了DBT中载脂蛋白的改变。为了筛选出有价值的潜在生物标志物,作者对已接受超过3个DBT治疗周期的患者建立了时间序列的线性回归模型和评估患者的医学放射成像,结果显示APOC3有作为DBT生物标志物的巨大潜力。
随后作者还基于蛋白质组学和临床数据建立机器学习模型以预测患者对DBT的响应和的疾病进展状态。
总而言之,该研究通过整合血浆蛋白组和临床数据,挖掘了关键的候选生物标志物,随后作者基于蛋白质组临床特征的机器学习模型提供了对 DBT 队列的准确预测,更确定了可潜在生物标志物的物质。该研究结果可作为未来针对精准免疫治疗反应的临床试验基础。














