本期解读

一、研究背景
2型糖尿病是发达国家终末期肾病(ESRD)的最常见原因。目前的治疗依赖于治疗高血糖和控制高血压,重点是抑制肾素-血管紧张素-醛固酮系统(RAAS)。尽管尝试了血糖和血压控制,糖尿病肾病(DN)还是会在许多患者中发展,这表明需要额外的方法来抑制DN的发展。

二、研究结果
1.1.敲除肾脏中的Smad4可改善肾功能并阻止2型DN的进展
为了研究Smad4在2型DN进展中的作用,作者使用锁定核酸(LNA)全身给药来敲除肾脏中Smad4 mRNA和蛋白质的表达。LNA是核酸类似物,其中核糖环被亚甲基桥“锁定” ,从而提高了靶标特异性和对核酸外切酶和核酸内切酶的抗性,从而在体内具有出色的稳定性。特别是LNA反义寡核苷酸表现出优先被肾脏摄取。
作者首先在足细胞中添加Smad4 LNA,培养4天后验证了Smad4的有效敲除,而对照-LNA (CTL LNA)不影响Smad4表达(图1A)。进一步通过对小鼠进行Smad4 LNA和CTL LNA注射治疗实验,发现Smad4 LNA有效下调肾脏中的Smad4水平,但不影响Smad3或糖酵解酶PKM2的蛋白水平,证明了从小鼠分离的足细胞中Smad4的有效敲除,并且不影响肝脏、肺和脾脏中Smad4的表达(图1B-H)。与CTL LNA治疗相比,Smad4 LNA治疗还显著降低了肾小球硬化的严重程度和DN的白蛋白尿(尿白蛋白与肌酐比),改善了肾功能(血清胱抑素C水平)(图1I-Q)。以上数据表明Smad4 LNA治疗可以靶向选择性地敲除肾脏中的 Smad4表达并阻止DN的进展,而与糖尿病状态无关。
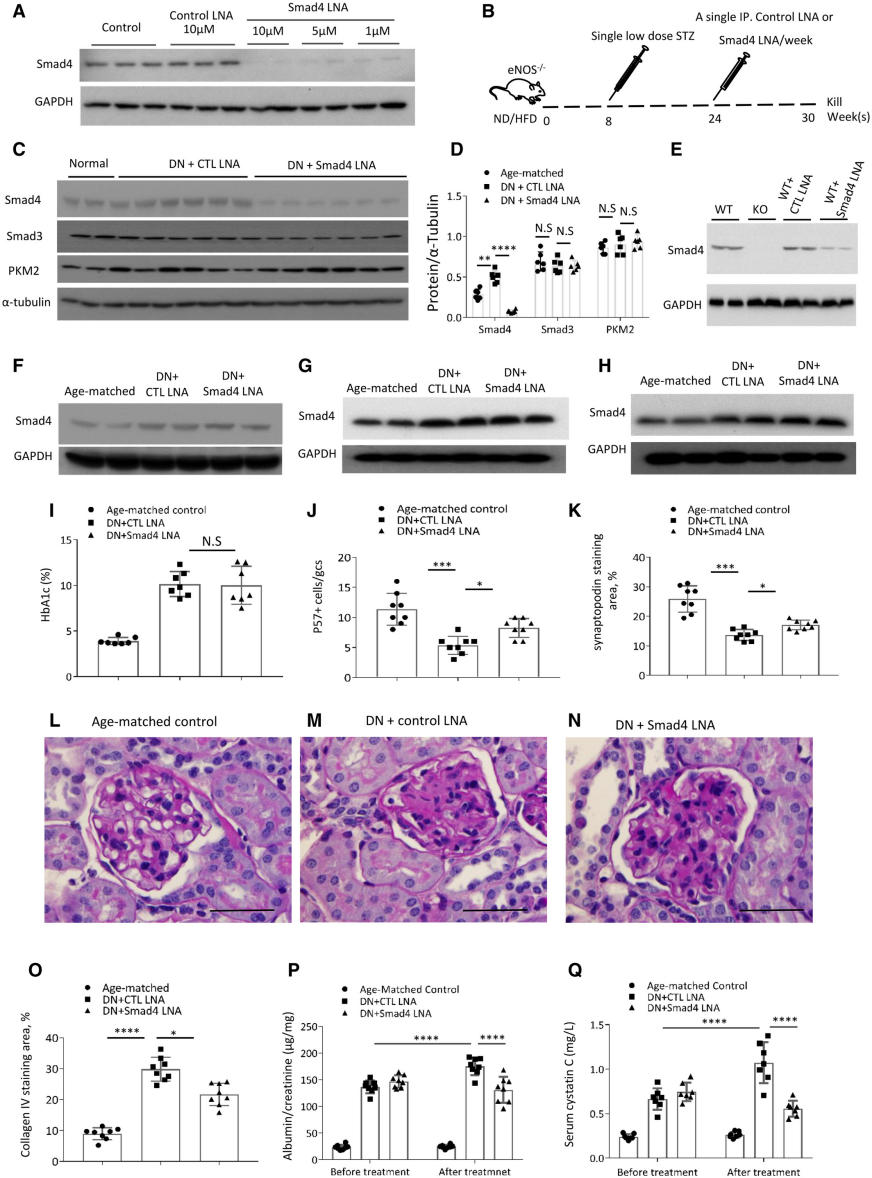
图1 Smad4 LNA降低Smad4表达并阻止2型糖尿病肾病的进展。
2.2型DN足细胞中Smad4的上调
作者检测了人和小鼠DN中足细胞Smad4的表达。共聚焦显微镜显示正常人肾脏中肾小球细胞(包括 WT1+足细胞)中的Smad4染色,Smad4与线粒体标记物Tom20的共定位相对较少(图2A-H)。在糖尿病肾病的肾小球足细胞中Smad4表达明显增加,在一些细胞中Smad4和Tom20的共定位明显(图2I-P)。正常小鼠肾脏的足细胞中Smad4与Tom20几乎没有共定位(图3A-H),然而糖尿病肾脏在肾小球中表现出Smad4的上调,部分Smad4蛋白在一些肾小球细胞(包括足细胞样细胞)中与Tom20共定位显著(图3I-P)。足细胞中Smad4的上调是小鼠DN早期行为,分离的足细胞的蛋白质印迹显示糖尿病4周后Smad4蛋白水平增加(图3Q-S)。这些发现表明Smad4在足细胞代谢中的潜在作用。
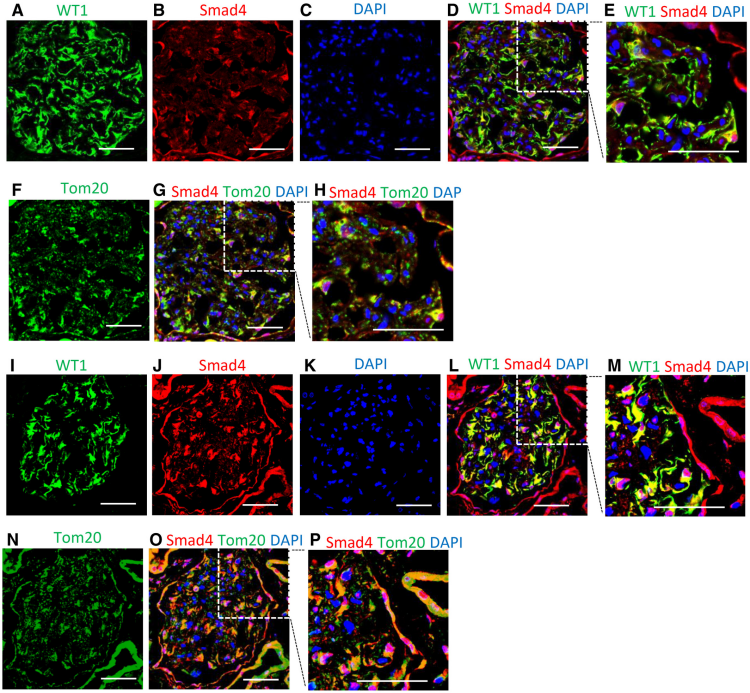
图2 Smad4 在人类糖尿病肾病中的表达增加。
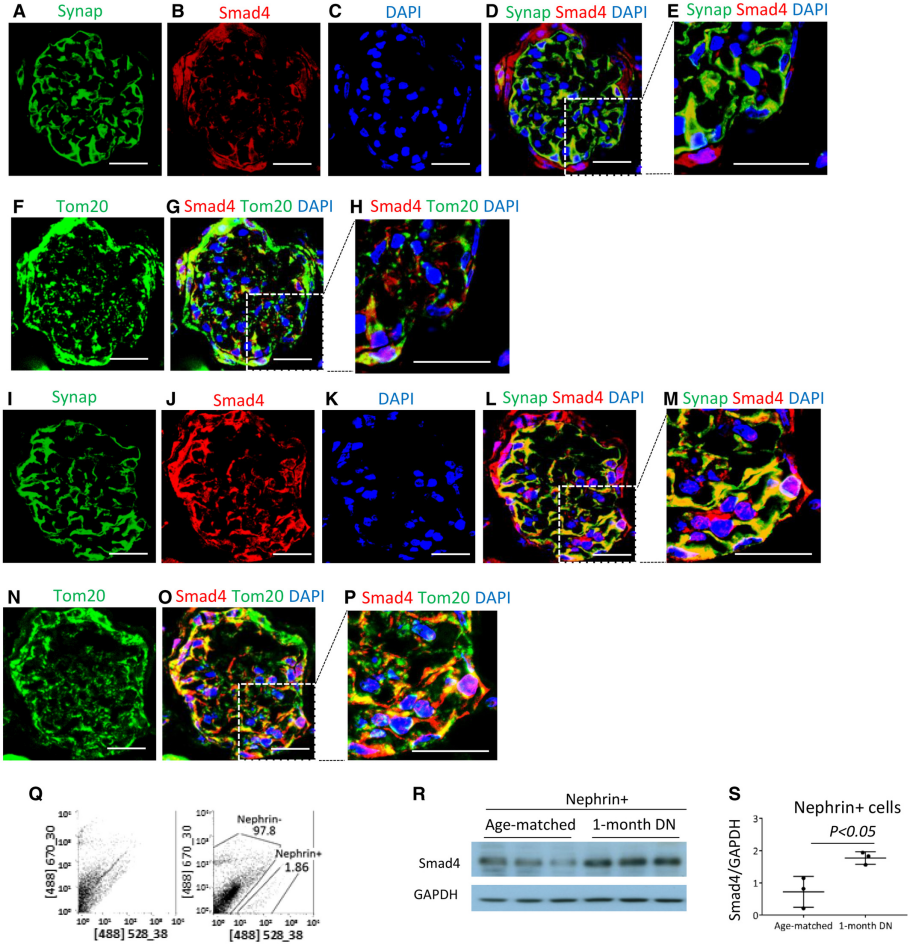
图3 Smad4 在小鼠糖尿病肾病中的表达增加。
3.足细胞中Smad4缺乏可保护肾功能
为了明确Smad4是否影响2型DN中足细胞功能的问题,作者在C57BL/6J背景上生成了足细胞中Smad4缺失的eNOS-/-小鼠(eNOS-/-; PodCre-Smad4flox/flox小鼠)。Western印迹分析证实了eNOS-/-小鼠的足细胞中Smad4的有效缺失(图4A)。与对照糖尿病小鼠相比,糖尿病eNOS-/-; PodCre-Smad4-/-小鼠在p57+足细胞丢失和足细胞特异性蛋白nephrin下调方面对足细胞损伤具有显著保护作用(图4B-D)。对照糖尿病小鼠表现出肾小球肥大、系膜基质扩张、肾小球硬化(肾小球IV型胶原蛋白沉积增加)、肾功能下降(血清胱抑素C增加)和白蛋白尿(尿白蛋白/肌酐比值增加)(图4 E-I) 。相比之下,糖尿病eNOS-/-; PodCre-Smad4-/-小鼠显示出对系膜基质扩张和肾小球硬化的显著保护,尽管肾小球肥大仍然很明显(图4E-G)。此外,糖尿病eNOS-/-; PodCre-Smad4-/-小鼠表现出肾功能改善和蛋白尿减少(图4H-I)。尽管糖尿病和肥胖症未改变,足细胞中的Smad4缺乏保留了肾功能并保护小鼠免受肾损伤。
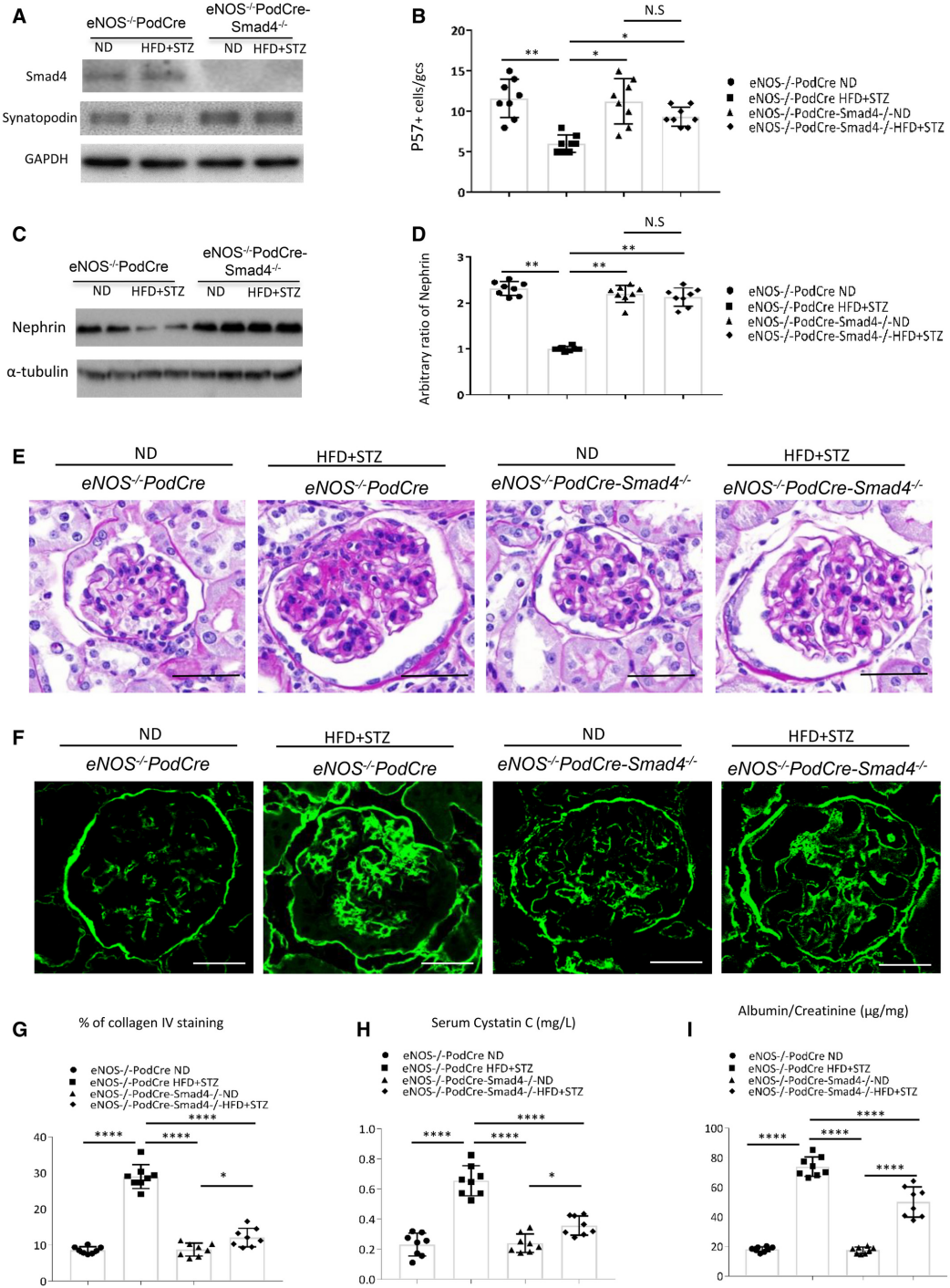
图4 足细胞中Smad4缺乏可减少2型糖尿病肾病(DN)的肾损伤。
4.足细胞中Smad4缺乏促进高糖条件下的糖酵解和OXPHOS活性
研究证明,糖酵解是足细胞中细胞内ATP产生的主要贡献者,并且磷酸果糖激酶在足细胞足突中表达,这表明糖酵解在正常足细胞功能中的重要作用。作者进一步研究了足细胞中Smad4缺失的保护作用是否与糖酵解有关。Seahorse糖酵解压力测试和海马细胞线粒体压力测试表明Smad4缺乏会增加OXPHOS活性(图5A-D)。Smad4缺乏并没有改变线粒体形态和线粒体拷贝数,也没有改变三种限速糖酵解酶或线粒体生物发生标志物PGC-1α的蛋白水平(图5E-H)。与野生型足细胞相比,缺乏Smad4的足细胞具有更大的乳酸产生能力,并且在正常和高葡萄糖条件下都减少了活性氧(ROS)的产生(图5I-M)。此外,Smad4缺乏阻止了高葡萄糖诱导的NOX4表达上调和突触足蛋白下调(图5N)。NOX4是肾脏中ROS的主要来源,DN和足细胞中的NOX4因高糖反应而增加。足细胞特异性Nox4缺失可保护小鼠免受糖尿病肾病的影响,这种保护与肾脏ROS产生减少有关。因此,Smad4缺失促进糖酵解,调节OXPHOS活性,降低NOX4表达和ROS产生,并防止高糖诱导的足细胞损伤。
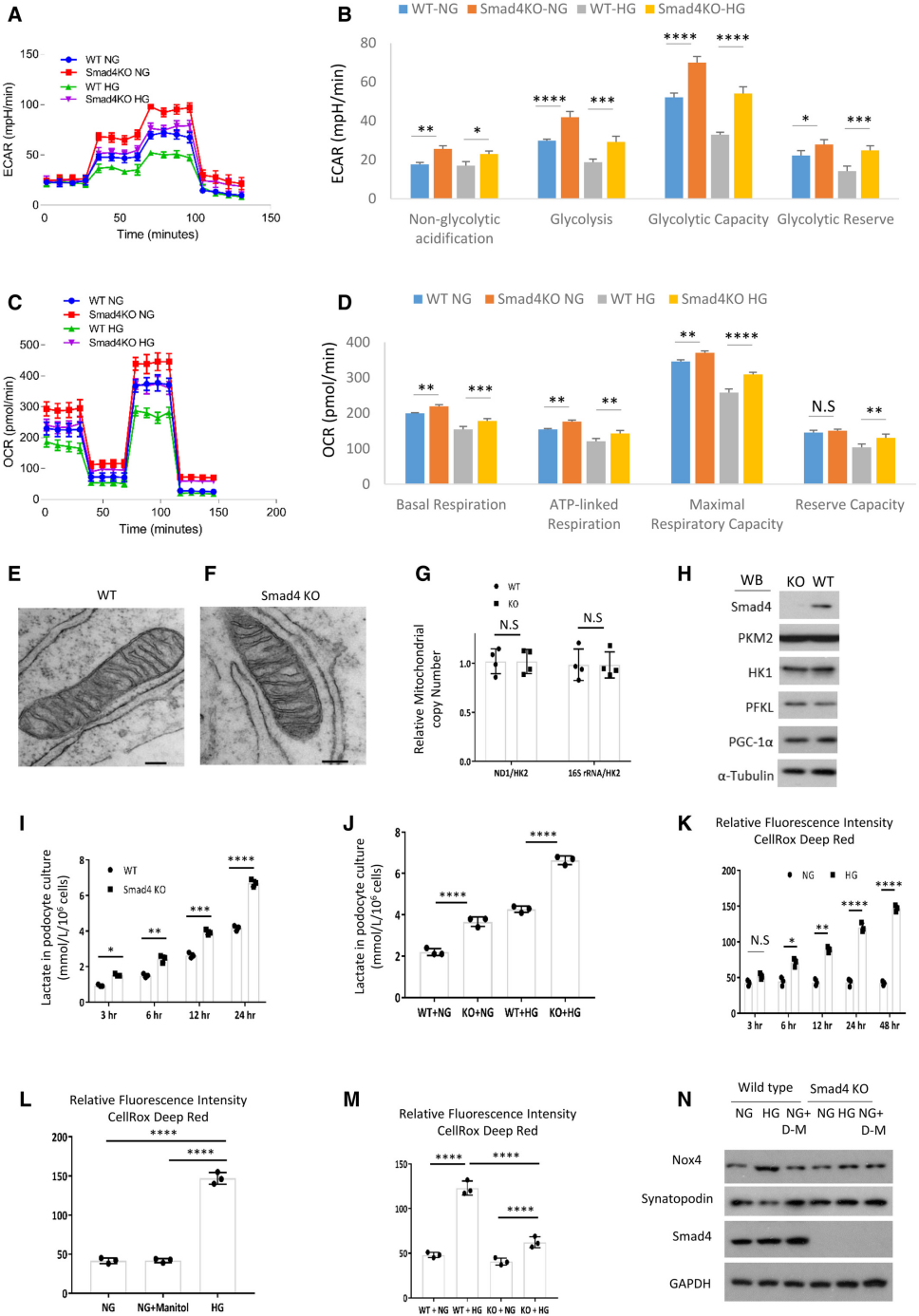
图5 Smad4缺乏会增加糖酵解和乳酸的产生,减少活性氧并保护足细胞免受高糖诱导的损伤。
5. Smad4通过与PKM2相互作用调节足细胞中的糖酵解
接下来,作者研究了Smad4调节足细胞糖酵解的机制。在分离的足细胞中确定了非糖尿病细胞中Smad4和PKM2之间的结合,并且这种相互作用在糖尿病小鼠的足细胞中增加(图6A-D)。培养的Smad4-/-足细胞在高葡萄糖培养条件下,随着Smad4和PKM2之间的相互作用增加,乳酸产量下降,并且在正常和高葡萄糖条件下均显示出PKM2活性的增加(图6E-F),这表明Smad4可能调节PKM2活性。PKM2的活性形式具有四聚体结构,而二聚体和单体形式是无活性的。交联研究表明,足细胞的高葡萄糖刺激导致 PKM2(四聚体)的活性形式减少,而Smad4缺陷型足细胞在正常和高葡萄糖条件下均表现出更显著的高水平PKM2四聚体(图6G-H)。作者进一步将293T细胞与带有Flag标记的PKM2和HA标记的Smad4表达质粒共转染,并进行了交联研究,证明Smad4与PKM2相互作用抑制了PKM2四聚体的形成(图6I),进一步的免疫沉淀实验证明Smad4对糖酵解的调节不依赖于Smad4核功能(图6J-P)。
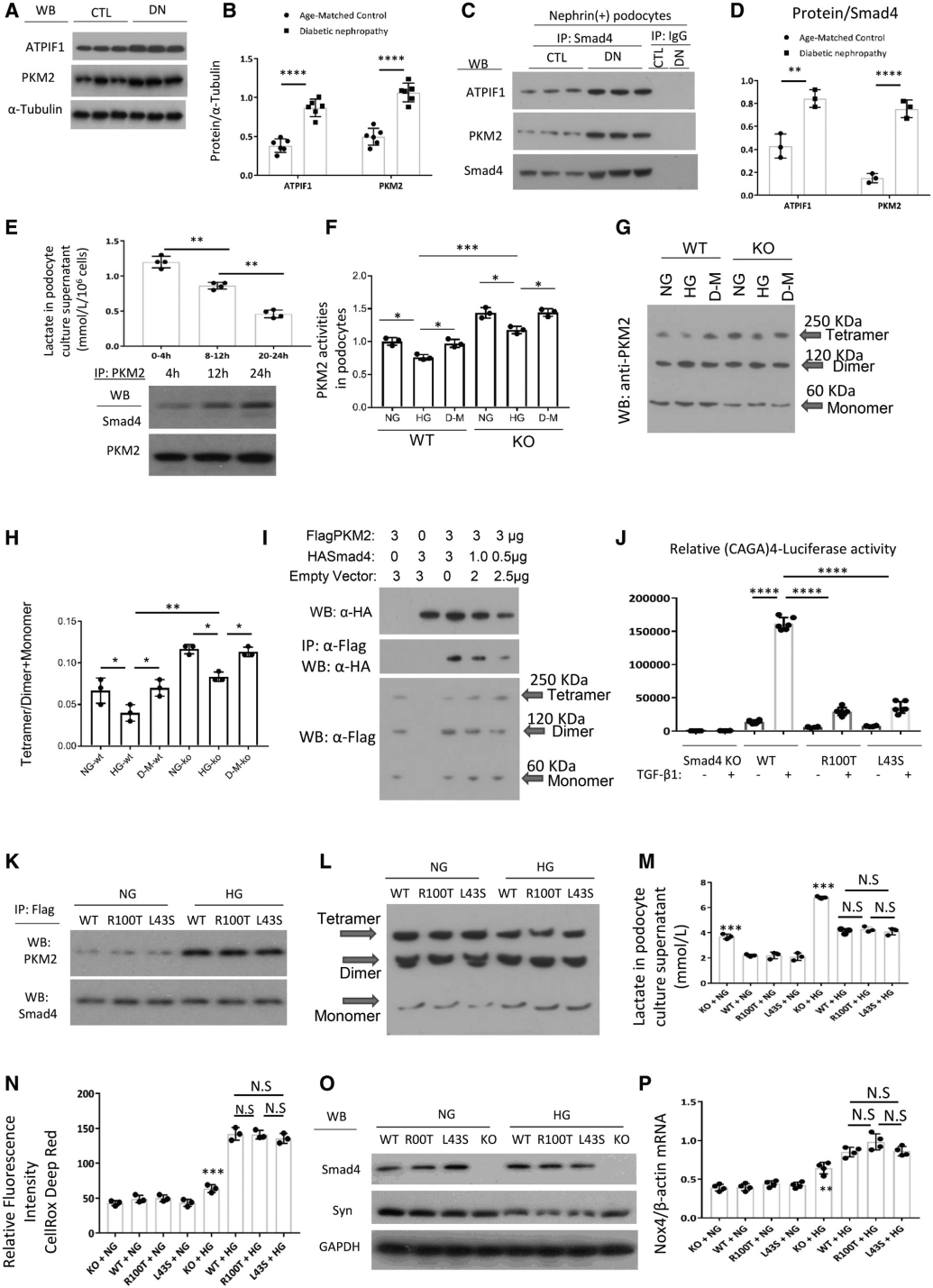
图6 Smad4与PKM2相互作用以调节PKM2四聚体的形成并调节足细胞中的乳酸生成。
6. 定量蛋白质组学分析确定Smad4缺陷足细胞中ATPIF1的下调
作者利用基于质谱的定量蛋白质组学分析了Smad4调节线粒体OXPHOS活性的分子机制,在四个实验组中鉴定到5228个蛋白质组,确定了下调和上调蛋白质的数量(图7A)。GO和KEGG富集分析表明,代谢过程、结合和催化活性是涉及Smad4的高度富集通路(图7B)。与正常和高葡萄糖条件下的WT足细胞相比,Smad4缺乏会显著降低哺乳动物组织中ATP 酶抑制因子1(ATPIF1)、ATP合酶抑制剂和OXPHOS活性调节剂的蛋白质水平。此外还发现线粒体丙酮酸载体1(MPC1)的下调,MPC1控制丙酮酸流入线粒体以产生OXPHOS,以及参与线粒体呼吸链的蛋白质,如Ndufs4、Ndufb10、Uqcrb、Cox7a21和Cox5a(图7C)。
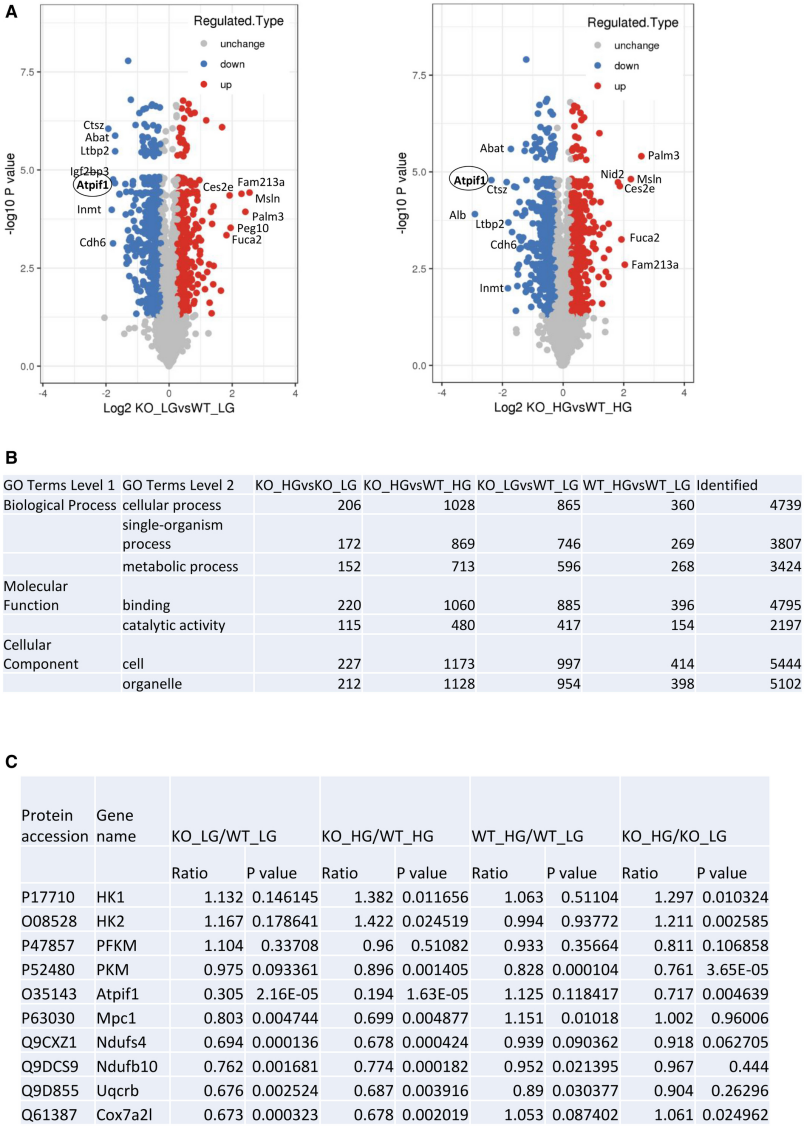
图7 正常葡萄糖(NG)或高葡萄糖(HG)处理下野生型(WT)和Smad4敲除(KO)小鼠足细胞的定量蛋白质组学分析。
7. Smad4与ATPIF1结合并减少ATPIF1降解
作者进一步研究了足细胞中Smad4缺乏导致ATPIF1下调的机制。蛋白印迹证实在正常和高葡萄糖条件下Smad4缺陷足细胞中ATPIF1和MPC1蛋白水平显著降低,并且Smad4缺乏显著保护足细胞免受高葡萄糖诱导的ATP产生损失,表明Smad4缺乏通过下调ATPIF1增加了ATP合酶的活性(图8A-B)。Smad4缺乏不会改变小鼠足细胞中的ATPIF1 mRNA 水平(图8C)。通过检测小鼠足细胞中ATPIF1蛋白的稳定性,发现 ATPIF1 蛋白在线粒体蛋白酶抑制剂邻菲咯啉(O-Phe)的作用下非常迅速地积累,降低了ATPIF1蛋白的半衰期(图8D-F)。
免疫沉淀研究表明,随着强力霉素(dox)浓度的增加,Smad4敲除存在剂量依赖性,这导致ATPIF1蛋白水平降低,同时Smad4与ATPIF1的结合减少(图8G),这表明Smad4与ATPIF1的相互作用可能会保护ATPIF1免于降解。Seahorse分析表明基础呼吸、最大呼吸和ATP相关呼吸的剂量依赖性增加,同时Smad4和ATPIF1下调(图8H-J),表明Smad4通过ATPIF1调节线粒体OXPHOS活性。此外,Smad4R100T/ATPIF1和Smad4L43S/ATPIF1相互作用与Smad4WT/ATPIF1相互作用相当(图8K)。表达Smad4WT、Smad4R100T或Smad4L43S的足细胞之间的基础、最大和ATP相关呼吸、质子泄漏或ATP水平没有显著差异(图8L-N)。总之,研究数据表明Smad4可能与ATPIF1相互作用以调节OXPHOS活性。MPC1的表达水平降低进一步表明Smad4缺乏可能通过限制丙酮酸流入线粒体和增强小鼠足细胞中的OXPHOS活性来提高OXPHOS效率。
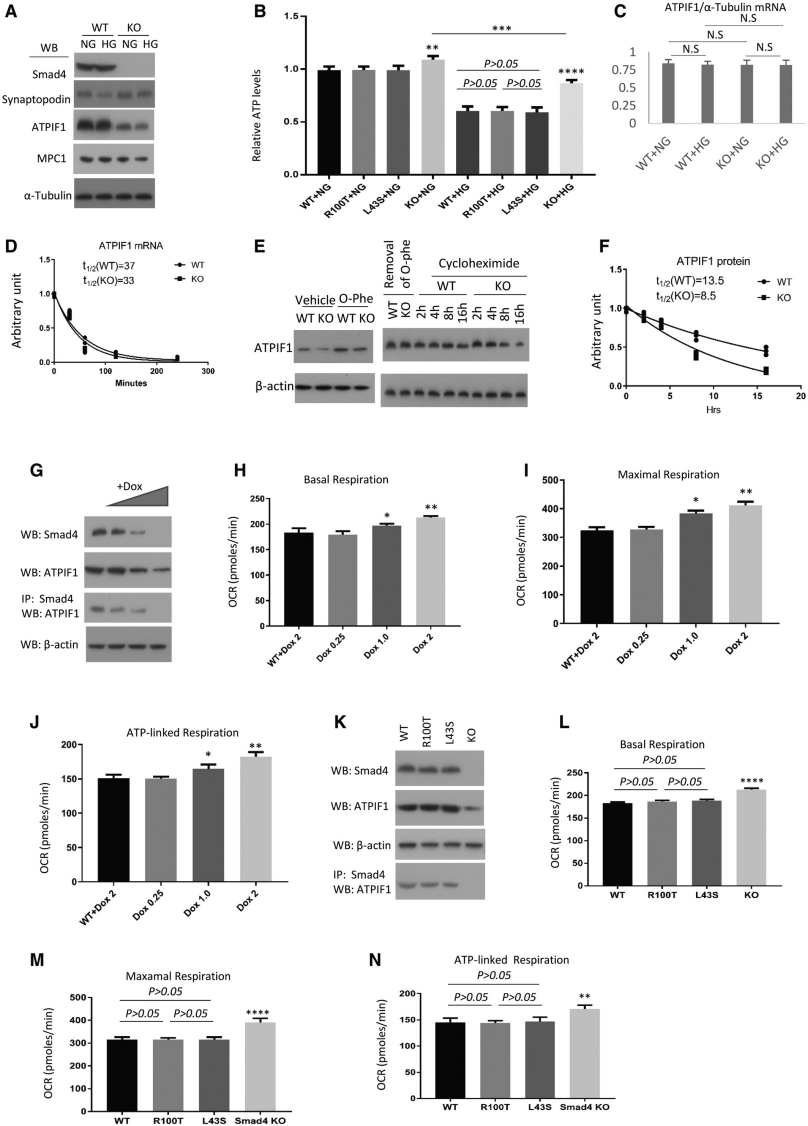
图8 Smad4与ATPIF1相互作用调节小鼠足细胞线粒体氧化磷酸化活性。

三、结论
此研究揭示了细胞质Smad4在调节糖酵解和OXPHOS中以前未被识别的作用,表明抑制肾脏中Smad4活性的药理学方法可以代表治疗2型DN的治疗策略,为Smad4在糖尿病肾病发病机制中的作用提供了新的见解。
文章链接:
https://doi.org/10.15252/embr.201948781
参考文献:
Jinhua L. Yubo YS. Weiyi C. et al. Smad4 promotes diabetic nephropathy by modulating glycolysis and OXPHOS[J]. EMBO Reports, 2020, (21): e48781.
编辑丨Aaliyah
审核丨Tao Li














