肺移植术是治疗肺部终末期疾病的重要手段,但异体移植排斥(AR)和肺部感染(PI)的术后并发症仍是影响患者生存率和降低手术成功率的重大问题,了解肺移植患者术后的机体相关生物学过程对于解决这一问题至关重要。有研究表明肠道微生物多样性的减少与同种异体移植病的病因和严重程度相关,可以调节同种免疫和排斥反应,但其是否与肺移植中的同种异体移植疾病有关还尚不清楚。

海军军医大学等机构在《Signal Transduction and Targeted Therapy》期刊发布题为"Intestinal microbiota links to allograft stability after lung transplantation: a prospective cohort study"的文章,报道了肠道微生物的代谢物与肺移植的异体排斥和感染有关的相关研究。
研究背景
肺移植是终末期肺病患者的潜在治愈疗法。然而,与其他实体器官移植方式相比,肺移植后的总生存率仍然较差,严重的同种异体移植物排斥反应 (AR) 和肺部感染 (PI) 是移植后 1 年内最常见的并发症。这些疾病不仅是死亡的主要原因,而且还与慢性肺同种异体移植功能障碍(CLAD)有关。炎症性同种异体移植物事件,如原发性移植物功能障碍,与 AR 和 PI 的后续发展有关。然而,肺排斥反应和感染易感性尚不完全清楚。
在先前的研究中,肠道微生物多样性的减少与同种异体移植病的病因和严重程度相关,肠道微生物组还可以调节同种免疫和排斥反应,还有直接表明肠道微生物组是器官移植的治疗靶点的。此外,来自接受肝肾移植的患者的纵向研究表明,移植后肠道微生物群的破坏的特征是重要代谢途径的多样性丧失和单一物种的统治,以及抗生素耐药基因的流行率增加,这些结果均表明潜在的肠道微生物组靶向干预措施可能会影响接受实体器官移植的患者的生存。
技术手段
实验材料:异体移植排斥(AR)、肺部感染(PI)和健康无事件(EF)的85例肺移植受者(LTRs)的146对粪便和血清样本;
研究方法:代谢组、宏基因组、机器学习
主要研究内容
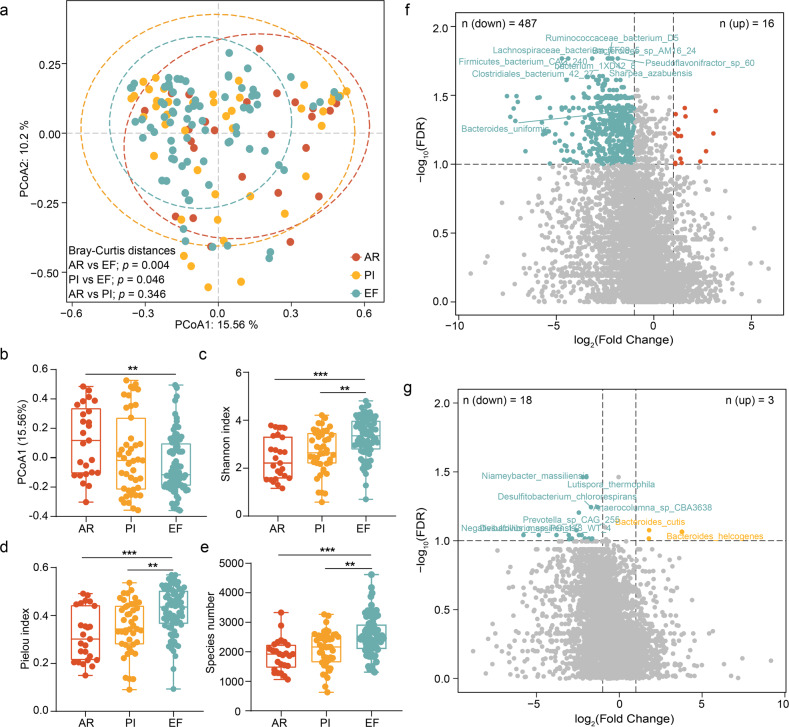
粪便样本中的菌群的变化
对所采集的粪便样本进行分析,发现其中多种高丰度的菌群分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。主坐标分析(PCoA)在物种水平上的评分图显示,与EF相比,AR/PI的肠道微生物组整体结构发生了可检测到的变化,
与EF相比,AR标本中总共有487个物种被耗尽,其中16个物种富集。(KEGG)分析表明,在AR样品中,甘露糖的生物合成、寡糖转移酶的N-糖基化和甲烷代谢受到显著干扰。相关性分析表明,新陈代谢减少与益生菌降低呈正相关,此外,抗生素耐药基因分析显示,在EF标本中观察到更多的无抗菌脂肪酸和莫匹罗星相关物种。
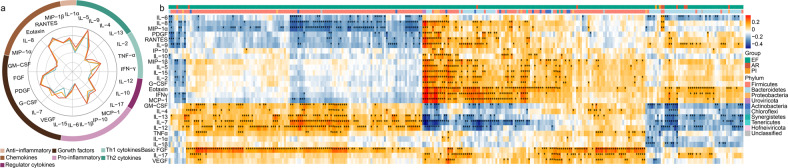
粪便微生物组的变化与全身免疫状态相关
基于对肠道微生物群在 AR 和 PI 中显着改变的观察,作者假设这些组成变化通过导致免疫反应失调而在加剧疾病中发挥作用。为了研究肺移植后免疫谱的改变,比较了三组中 27 种细胞因子的血清水平,包括 7 个功能类别,检测到的细胞因子参与组织重塑、免疫调节、炎症等。三组的模式差异显著。AR 和 PI 患者表现出显着的炎症应激,IL-6、IL-12、IL-17 和 TNF-α 等 12 种细胞因子显着上调。随后,作者发现肠道菌群与相关性分析中上调的细胞因子显著相关。血清IL-6被确定为移植物排斥的关键因素,与AR患者肠球菌属和乳球菌属的增加呈正相关。此外,16 种拟杆菌和 7 种梭状芽孢杆菌的减少与 IL-6 呈负相关。有趣的是,作者发现 3 种肠球菌噬菌体富含 EF 并据报道可以减少致病菌,对正常菌群的损害最小,与几种炎症细胞因子(MIP-1β、IL-1α、TNFα 和 IL-17)呈负相关。此外,拟杆菌与IL-1β和IL-12呈负相关,这表明肠道微生物组可能通过调节肺移植中的宿主免疫反应参与同种异体移植疾病。
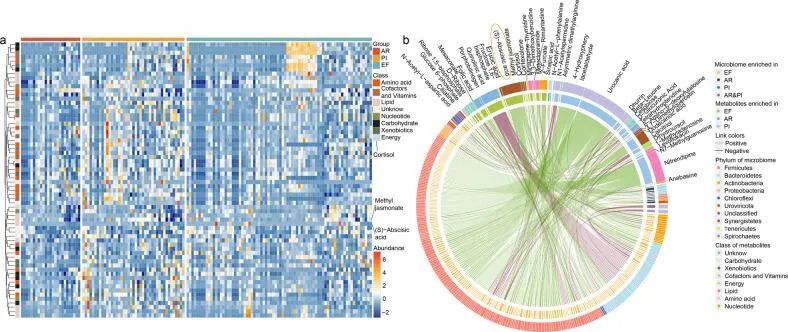
粪便宏基因组的变化与血清代谢物相关
接下来,作者想了解哪些环境因素影响了肠道微生物组改变的水平。众所周知,血清代谢物在介导微生物组与其宿主之间的代谢和免疫相互作用中起着关键作用,从而为环境暴露的复杂动态提供了基本视图。与肠道微生物组一致,AR 个体表现出明显血清代谢物水平的变化。作者在三组中鉴定出52种改变的代谢物,发现降低脂质((S)-脱落酸、茉莉酸甲酯和皮质醇)与来源于拟杆菌门(28种)和梭状芽胞杆菌(20种)这些减少的益生菌呈正相关。其中,据报道,(S)-脱落酸通过过氧化物酶体增殖物激活受体γ(PPAR-γ)信号传导减少肺损伤,而(S)-脱落酸与86个物种的缺失密切相关。此外,拟杆菌均匀性的丧失与喹啉酸的增加显着相关,喹啉酸是众所周知的神经毒素。这些结果表明,肠道益生菌在AR的发展中起着潜在的保护作用,由一系列循环血液代谢物介导,其中一些先前被证明在肺部炎症中起着核心作用,而其他的则没有报道。因此,在实验研究中进一步验证后,这些代谢物可能会形成新的靶点以减轻疾病风险。
作者通过采用临床参数(包括血细胞计数和血清细胞因子)构建机器学习模型,并使用肠道微生物组的显着变化物种和显着干扰的血清代谢物来区分 AR、PI 或 EF 与受试者,
在识别 AR、PI 或 EF 时,精确回忆曲线 (PRC) 显示,基于临床参数的 SVM 模型的预测功效明显低于使用验证样本中微生物组和代谢组数据的模型。然而,单个微生物组(精密度-召回曲线下面积,AUPRC 范围 = 0.703–0.764)和代谢组(AUPRC 范围 = 0.605–0.654)也不太有效。基于多组学数据(整合临床、微生物和代谢特征)的 SVM 模型准确预测了验证受试者的 AR、PI 或 EF(AR 的 AUPRC = 0.801,PI 的 AUPRC = 0.855,EF 的 AUPRC = 0.809)。这些数据支持多组学在肺移植中诊断 AR 和 PI 方面的高预测能力。














