透明细胞癌(CCC)、子宫内膜样癌(EC) 和浆液性癌(SC)是上皮性卵巢癌 (EOC)的主要组织学亚型,但其致癌作用的差异尚不清楚。
中国医科大学附属盛京医院等机构《Nature Communications》期刊发布题为"Proteomic characterization of epithelial ovarian cancer delineates molecular signatures and therapeutic targets in distinct histological subtypes"的文章,报道了通过对不同的组织学癌症类型进行蛋白质组学分析,发现了每种组织学癌症亚型的生物学特征和潜在的预后生物标志物、疾病进展标志物、治疗靶点。
研究背景
在该项工作中,作者收集了 269 个 EOC 样本,旨在基于蛋白质组学分析对 EOC 进行全面表征,以增加对这种致命恶性肿瘤相关分子特征的了解。通过比较 EOC 和对照组织 (CT) 样品的蛋白质组学特征揭示了失调的蛋白质和异常的信号通路。通过蛋白质共表达网络反映了每个共表达模块的生物学特征,还提出了潜在的预后生物标志物和进展标志。通过蛋白组组学分析发现EOC的组织学亚型之间存在很强的异质性,根据蛋白表达水平、预后能力和成药性,作者还分别预测每种亚型的潜在治疗靶点。
研究方法:蛋白质组学、PRM、Transwell试验
主要结果
蛋白质组学景观突出了EOC临床特征的异质性和差异
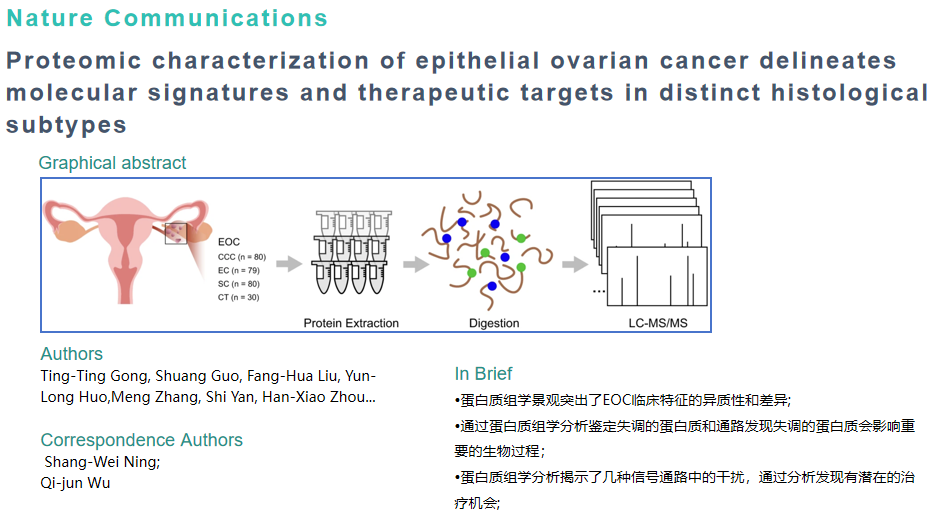
作者收集了 239 个 EOC 样本 (SC, n = 80;EC, n = 79;和 CCC,n = 80)和 30 个 CT 样本进行蛋白质组学分析(图a),在所有肿瘤样本中共鉴定出8257种蛋白质。经均匀流形近似和投影(UMAP)分析表明,肿瘤和非肿瘤样本的蛋白质组之间以及 EOC 病理亚型之间存在明显差异(图b)。为更好的描述EOC的肿瘤间异质性,作者表征了病理亚型中患者的临床信息,结果发现与EC和CCC相比,SC患者在诊断时年龄较大,易复发(图c),SC比EC和CCC更具有晚期肿瘤分期(图d)。特别是,对EOC组织学亚型的生存特征评估显示SC、EC和CCC的总生存期(OS)和无复发生存期(RFS)存在显著差异(图e),其中,SC的生存率显著降低,术后死亡和复发的风险更高。通过亚细胞定位分析发现大多数检测到的蛋白质来自细胞核。这些结果暗示了潜在的蛋白质靶标和失调的生物过程 (BPs)(图f)。
失调的蛋白质会影响重要的生物过程
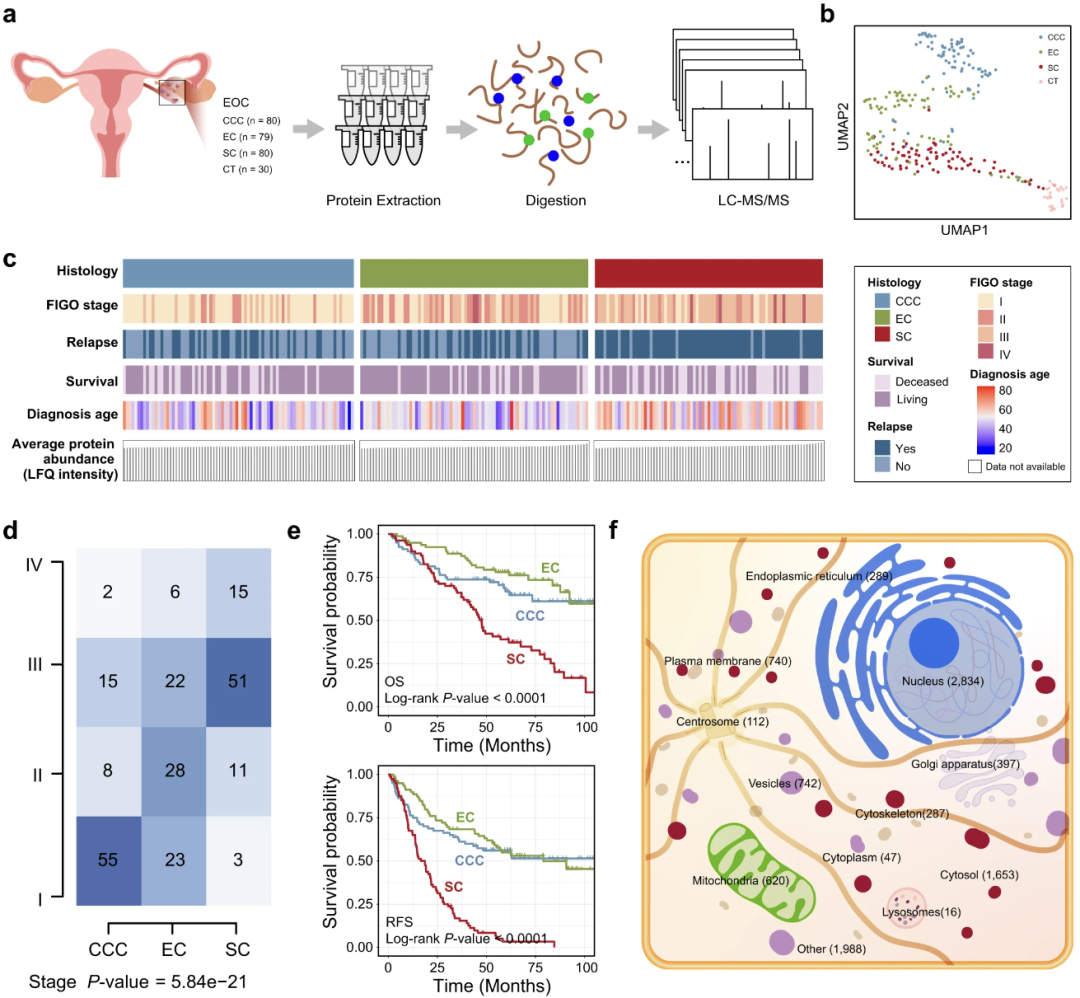
根据蛋白质组学数据鉴定了肿瘤中失调的蛋白质。质控后得到的4447个高质量蛋白,肿瘤样本中分别有295个和927个蛋白显著上调和下调(adj.P值<0.01和|log2(倍数变化)| >1,图a),分析发现大多数失调的蛋白质在肿瘤组织中倾向于下调,上调的蛋白质比下调的蛋白质具有更高的平均表达。对倍数变化大于2的失调蛋白进行功能富集分析,GO分析表明,下调蛋白在BPs中显著富集,包括:细胞死亡、DNA修复/损伤、发育和免疫反应等,而富集在上调蛋白中的BPs有限(图b)、在KEGG通路方面,DNA复制、细胞周期、HIF-1信号通路和几种代谢相关通路在肿瘤样本中上调的蛋白质中过度表达,而PI3K-Akt信号通路、黏着斑和细胞外基质(ECM)-受体相互作用在下调的蛋白质中过度表达(图c),癌症标志的GSEA分析显示,雌激素反应和氧化磷酸化标志在上调的蛋白质中过度表达,而通过NF-κB的细胞凋亡、EMT、TNFA信号传导等通路在EOC中下调的蛋白质中过度表达(图d),这表明肿瘤细胞的增殖和转移可能通过异常的蛋白质和途径促进。此外,作者在McDermott等人的卵巢癌队列(临床蛋白质组学肿瘤分析联盟,CPTAC队列)中纳入了具有良好鉴别能力的蛋白质,以进一步验证,作者观察到,多个上调蛋白表现出很强的区分能力,平均AUC大于0.9(当前队列),并在CPTAC队列中进一步验证,平均AUC也大于0.8,外泌体蛋白列表来自ExoCarta 和Vesiclepedia 数据库,具有鉴别能力的蛋白与外泌体蛋白有重叠部分(图e),这些重叠的蛋白质可能为EOC研究提供更丰富的视角。
信号通路紊乱提示潜在的治疗机会
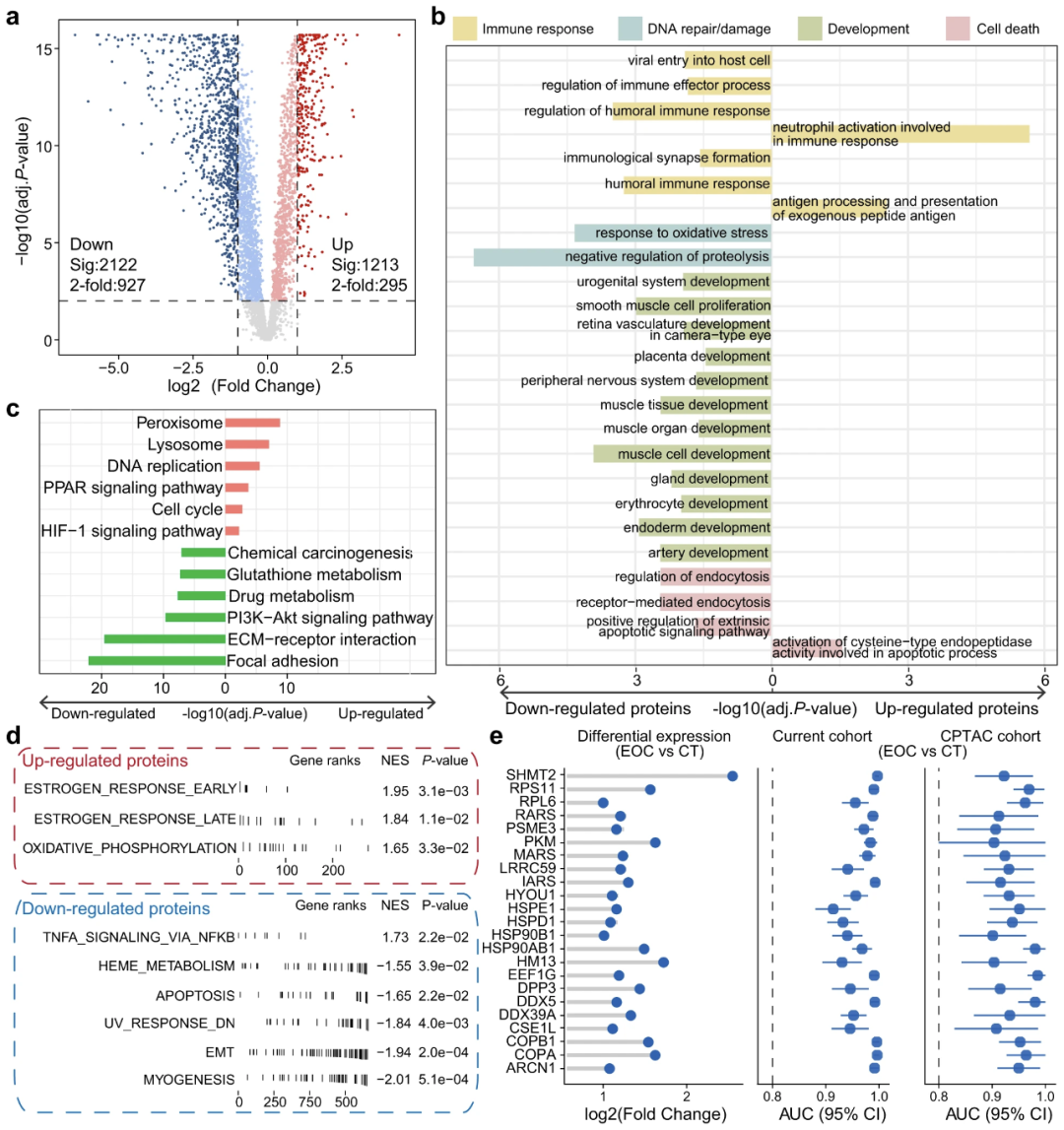
作者在蛋白质组学分析中发现了几种信号通路中的干扰,接下来作者试图从多组学的角度阐明这些干扰,其先整合了先前发表的磷酸化蛋白质组学数据(CPTAC 队列)和磷酸化蛋白质组学分析鉴定出上述途径中这些蛋白质的磷酸化位点失调,结果发现 DNA 复制通路中的蛋白质表现出全局上调模式,而失调的磷酸化位点在 Gap 1 阶段、Gap 2 阶段和有丝分裂阶段表现出更复杂的模式。HIF-1 信号通路也富含上调的蛋白质,而这些蛋白质的磷酸化在 CPTAC 队列中受到抑制。此外,我们发现 ECM 受体和 PI3K-Akt 信号通路在 EOC 中下调的蛋白质中过度表达,磷酸化位点也表现出下调模式。在药物-基因相互作用数据库(DGIdb)中鉴定出批准的药物靶蛋白,并在上述通路中突出显示(图 a)。通过单因素回归分析评估上述4个通路中失调蛋白的临床关联。CDK4、CDKN1B、COL1A2等多个知名治疗靶点对EOC死亡率预后的评价非常高,此外,包括COL1A1、COL1A2和COL6A3在内的ECM受体成员与RFS相关,在肿瘤样本中的表达明显低于对照组,表达较低与存活率更高相关,这表明介导细胞和基质成分之间关联的受体在EOC中发生了变化。特别是,在这些可靶向蛋白中,CDK4、CDKN1B和COL1A2在EOC的OS和RFS上都表现出非常高的风险评分(P值<0.05,图b)。
为了确定 CDK4、CDKN1B 和 COL1A2 蛋白表达的稳定性,作者使用平行反应监测 (PRM) 分析来靶向这些蛋白以量化其表达水平,并验证这些蛋白在 EOC 中仍低表达,结果表明,靶向这些蛋白可能在未来的临床治疗中被证明是有益的。
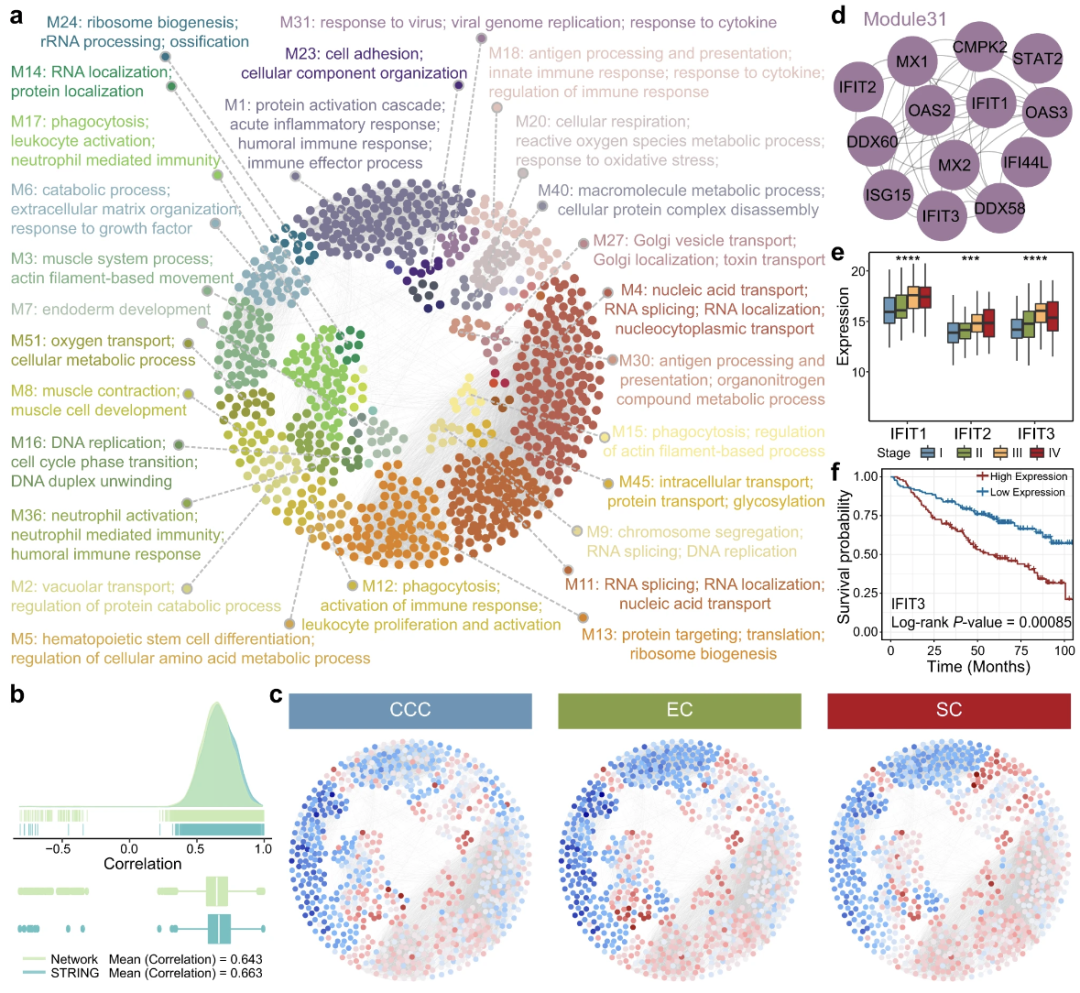
蛋白质互作网络表征可识别候选生物标志物和进展标志物
为了从蛋白质组范围的角度研究队列的生物学特征,作者使用加权基因共表达网络分析(WGCNA)构建了基于蛋白质表达谱的蛋白质共表达网络,获得了具有896个节点和13,574个边的蛋白质共表达网络(图a),几乎所有组织学亚型模块(97%)都与EOC模块具有统计学意义的重叠,说明EOC 模块和组织学亚型模块之间有更好的重叠。作者还通过CT来比较每种组织学亚型来评估蛋白质的异常表达水平(图d),分析得了IFIT3可能是EOC的候选生物标志物和进展标志物,ECM受体成员包括COL4A1、COL4A2和LAMA1也与组织学亚型和分期相关(图d,e),作者又通过PRM进一步验证了IFIT1、IFIT2、IFIT3、COL4A1、COL4A2和LAMA1这些蛋白得表达特性,发现这些蛋白在组织学亚型和阶段的表达水平与上述结果一致,反映了蛋白质的可重复性(图f,g)。
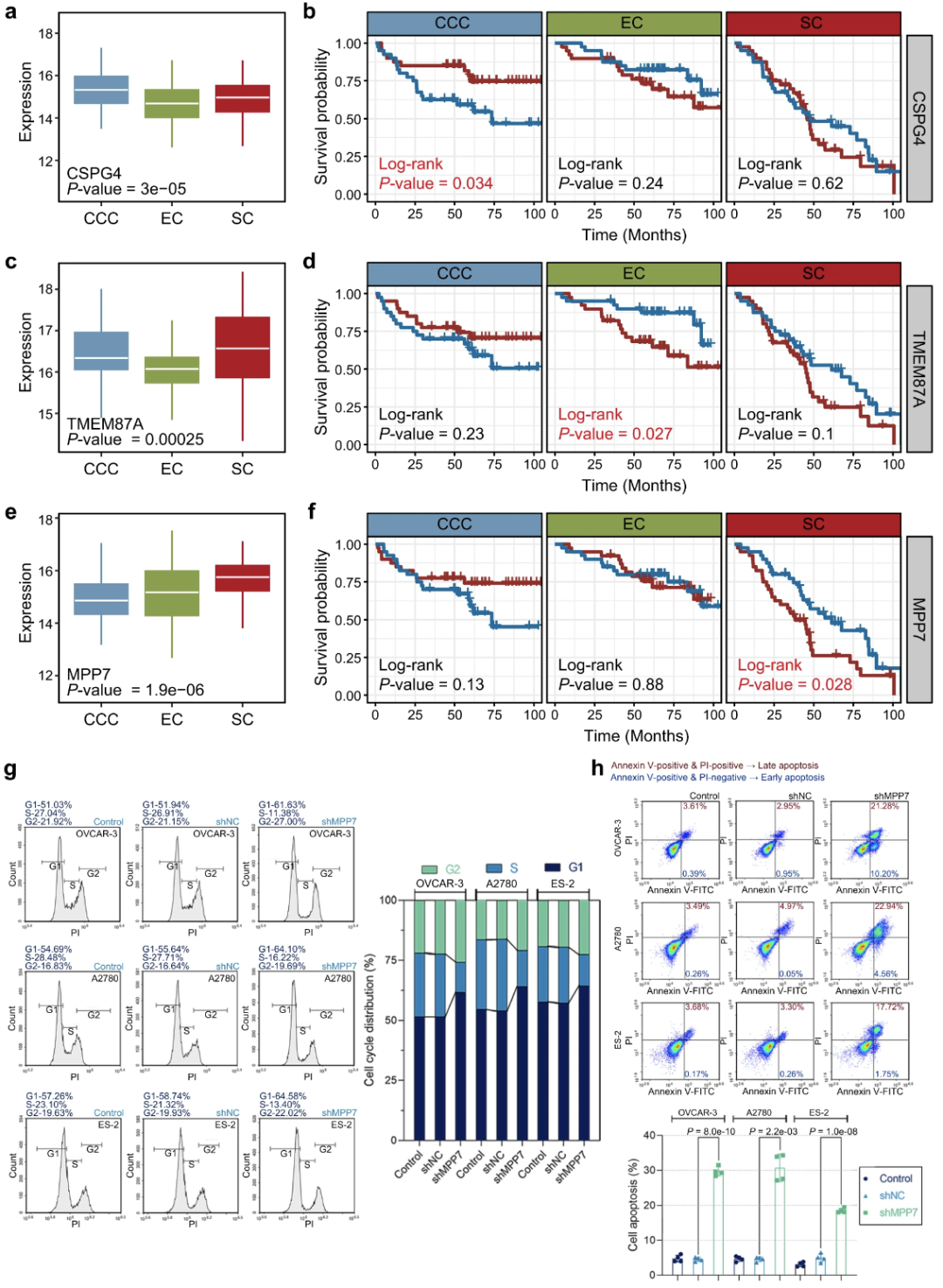
不同组织学亚型的潜在治疗靶点
作者试图为每种组织学亚型寻找潜在的药物靶点,首先,将EOC和CT中差异表达的蛋白与亚型特异性蛋白的交叉点作为候选蛋白列表。而后根据 Kaplan-Meier 曲线和 Cox 回归分析,确定每种组织学亚型的独立且显著的预后蛋白。在CCC中,与其他两种亚型相比,CSPG4高表达。此外,CSPG4仅在CCC中具有预后价值,而在其他组中没有预后价值(图a、b)。TMEM87A低表达主要见于EC患者,与EC患者的良好预后结果显著相关(图c,d)。MMP7蛋白在SC中显示出优异的治疗靶点潜力,具有亚型特异性高表达和预后能力(图e,f)。MPP7的预后价值也在CPTAC数据集中得到了验证。
根据MPP7的预后价值和SC的恶性程度,作者研究了MPP7在SC细胞中的体外功能。评估了细胞增殖、细胞迁移、细胞侵袭、细胞周期分布、细胞凋亡等恶性行为。细胞计数试剂盒-8 (CCK-8) 检测显示,shRNA 介导的 MPP7 敲低降低了细胞活力,表明MPP7敲低对细胞增殖的抑制。细胞周期的流式细胞术分析表明,MPP7敲低导致S期细胞减少,G1期和G2期细胞增加(图g),结果表明,MPP7参与了G1-S和S-G2转变的调控。细胞凋亡的流式细胞术分析表明,MPP7敲低诱导细胞凋亡(图h)、Transwell试验表明,MPP7敲低抑制了细胞迁移和侵袭, 综上所述,作者建议进一步分析这些亚型特异性蛋白,作为三种组织学亚型中有前途的治疗靶点。
研究结论
总的来说,在该项研究中作者基于蛋白质组学分析对EOC进行了全面的表征,拓宽了对与这种致命恶性肿瘤相关的分子特征的理解。EOC 和 CT 组织样本的蛋白质组学表征揭示了蛋白质失调和关键信号通路破坏的特征。蛋白质互作网络不仅提供了每种组织学亚型生物学特征的全球视角,还提出了潜在的预后生物标志物和进展标志。EOC显著的组织学亚型特异性表现在分期、存活率、复发率和信号通路调控等多个方面。基于组织学亚型在蛋白质丰度、预后能力和药物能力方面的明显差异,作者还分别预测了每种亚型的潜在靶点。体外实验进一步凸显了MPP7在SC细胞恶性行为中的重要性。这项研究为EOC的生物学表征、临床诊断和治疗提供了广泛的见解。














